De afgelopen maanden zijn we wereldwijd geconfronteerd met een uitbraak van het SARS-CoV-2 virus, resulterend in de ziekte COronaVIrus Disease 2019; COVID-19 (Khan et al, 2020). Dit virus behoort tot de familie van coronavirussen en heeft een enkelstrengs positieve RNA-keten, omgeven door een capside (Adhikari et al, 2020; Ashour et al, 2020). De envelop daaromheen heeft de voor deze groep virussen de kenmerkende proteïn spikes (afb. 1), waardoor elektronenmicroscopische foto’s van dit virus lijken op een kroon – in het Latijn: corona (Adhikari et al, 2020; Khan et al, 2020). Het virus veroorzaakt in de meeste gevallen milde tot ernstige klachten aan de luchtwegen, maar een asymptomatisch verloop is ook mogelijk (Kluytmans et al, 2020). Op 4 april 2020 is 39,8% van de 16.627 in Nederland positief geteste patiënten opgenomen (geweest) in het ziekenhuis. Van deze groep patiënten is 9,9% overleden (RIVM, 2020a). Lang niet alle SARS-CoV-2-positieve patiënten ontwikkelen koorts. Aangezien dit een nieuw virus is, is er onder de bevolking nog geen groepsimmuniteit tegen het virus opgebouwd. Daarnaast is het virus zeer besmettelijk, waarbij een met SARS-CoV-2 geïnfecteerd persoon gemiddeld 2 tot 3 personen infecteert (reproductiegetal R0, zie intermezzo 1) (Liu et al, 2020; Sun et al, 2020). Dit resulteert potentieel in een grote groep geïnfecteerde personen. Door het toepassen van isolatie en infectiepreventiemaatregelen kan het reproductiegetal worden verlaagd, waardoor een uitbraak kan uitdoven. Juist wanneer het merendeel van de besmette personen geen of slechts weinig klinische verschijnselen vertoont, is de kans zeer groot dat zij gemist worden in de signalering en daardoor niet meegenomen worden in de maatregelen. Zo kan het virus zich blijven verspreiden (Munster et al, 2020). Wanneer de R0 minder dan 1 is, dooft een uitbraak vanzelf uit.
Afb. 1. SARS-CoV-2 met de voor coronavirussen kenmerkende protein spikes. (Beeld: Shutterstock)
Intermezzo 1. Basaal reproductiegetal; R0
Dit getal, gewoonlijk aangegeven met het symbool R0 (lees: 'R-nul') en basaal reproductiegetal genaamd, is ruwweg het aantal nieuwe gevallen van de ziekte dat veroorzaakt wordt door 1 besmet individu. Het is duidelijk dat een R0 > 1 zal leiden tot een toename van het aantal besmetten in de populatie, terwijl de ziekte zich bij een R0 < 1 niet zal kunnen handhaven (Heesterbeek, 1993).
Het virus gebruikt de ACE2 (angiotensineconverterend enzym 2)-receptor van de gastheer om deze te infecteren (Xu et al, 2020). ACE2 speelt een belangrijke rol in het renine-angiotensine-aldosteronsysteem (RAAS), dat dankzij opeenvolgende reacties van eiwitten belangrijk is bij veel fysiologische sleutelprocessen, waaronder de regulatie van de bloeddruk. Medicatie voor de behandeling van hypertensie, zoals ACE-remmers, werken ook op het RAAS. Tot op heden zijn er geen éénduidige wetenschappelijke resultaten om aan te nemen dat deze medicatie de infectie met SARS-virussen of genezing van de infectie beïnvloedt (Vaduganathan et al, 2020). De ACE2-receptor is voornamelijk te vinden op cellen van de mucosale weefsels. Zo hebben cellen van de tongrug en de speekselklieren een grote dichtheid aan ACE2-receptoren (Liu et al, 2011; Xu et al, 2020). De mond, luchtwegen en ogen zijn een belangrijke porte d’entrée voor dit virus, waarna infectie en ziekte optreden. Deze porte d’entrée is tevens een reservoir van waaruit nieuwe infecties naar andere personen kunnen optreden. Juist op en in deze cellen worden veel virusdeeltjes gevonden, die weer kunnen worden uitgescheiden tijdens bijvoorbeeld hoesten. Sinds de opkomst van COVID-19 in de Chinese stad Wuhan heeft veelvuldig transmissie tussen mensen plaatsgevonden en heeft het virus zich binnen 3 maanden over de gehele wereld verspreid (Sun et al, 2020). Nu de uitbraak het karakter van een pandemie heeft gekregen en er nog geen geneesmiddelen of vaccins beschikbaar zijn, vormen infectiepreventiemaatregelen vooralsnog de enige mogelijkheid het aantal nieuwe besmettingen af te remmen (Lai et al, 2020).
Infectiepreventie in mondzorgpraktijken
Infectiepreventie in de zorg is het afwegen van risico’s; het volledig uitsluiten van risico’s is niet mogelijk. In het verleden was het uitgangspunt van infectiepreventierichtlijnen in de mondzorg het voorkomen van overdracht van bloed-overdraagbare aandoeningen. De laatste versie van de richtlijn ‘Infectiepreventie in mondzorgpraktijken’ is onder andere gebaseerd op de aanname dat een patiënt met een ernstige infectieziekte waarschijnlijk de mondzorgpraktijk niet bezoekt, in tegenstelling tot een ziekenhuis waar per definitie mensen komen met een ziekte. Hierdoor kan in de mondzorg op een manier gewerkt worden die een relatief beperkt effect heeft op werkbaarheid en de kosten van de mondzorg. De huidige richtlijn 'Infectiepreventie in mondzorgpraktijken' streeft, net als in meerdere andere landen ter wereld, naar een optimaal en werkbaar effect binnen de mondzorg in plaats van een maximaal effect (Centers for Disease Control and Prevention, 2003).
Opgemerkt dient te worden dat de mondzorg een bijzondere plek inneemt in de gezondheidszorg. De Nederlandse Vereniging voor Medische Microbiologie (NVMM) en de destijds nog bestaande commissie Werkgroep Infectie Preventie (WIP) hebben veel moeite gehad met de wijze waarop in de mondzorg omgegaan wordt met aerosolproductie. In de mondzorg worden bij het merendeel van de reguliere behandelingen aerosolen geproduceerd (zie intermezzo 2). In de medische wereld moeten bij ziekten die zich verspreiden via druppels of via de aerogene weg, FFP-maskers worden gedragen (Werkgroep Infectie Preventie, 2011b; Werkgroep Infectie Preventie, 2013; Werkgroep Infectie Preventie, 2017). Voor de mondzorg is hiervan afgeweken vanwege het feit dat patiënten die een mondzorgverlener bezoeken gemiddeld genomen tot de gezonde populatie behoren, zodat mondzorg betaalbaar en werkbaar blijft.
Intermezzo 2. Aerosolen
Aerosolen zijn vloeibare of vaste deeltjes die door mensen, dieren, instrumenten of machines geproduceerd worden en in de lucht komen. De kenmerken van aerosolen verschillen afhankelijk van omgevingsinvloeden zoals vochtigheid, luchtstroom en temperatuur. Aerosolen zijn verantwoordelijk voor de overdracht van micro-organismen door de lucht en bestaan uit kleine deeltjes die druppelkernen worden genoemd (1–5 ?m) of druppels (> 5 ?m). Druppelkernen kunnen lang in de lucht blijven, over lange afstanden worden vervoerd en oppervlakken vervuilen door naar beneden te vallen. De druppels en druppelkernen kunnen diep in de longblaasjes doordringen en zijn zo een mogelijke infectieroute. Beide maken deel uit van de aerosol (Zemouri et al, 2017).
Het coronavirus SARS-CoV-2
Dragerschap
Hoewel op het moment van dit schrijven (4 april 2020) in Nederland 16.627 personen gediagnosticeerd zijn met COVID-19 (incidentie ongeveer 98 per 100.000), ligt het daadwerkelijke aantal patiënten waarschijnlijk hoger omdat voornamelijk personen met risico op een ernstig ziektebeloop worden getest op het virus. Voorlopige berekeningen over de incubatieperiode wijzen uit dat deze gemiddeld rond de 5,1 dagen (CI 95% 4,5 – 5,8) ligt (Lauer et al, 2020). Er wordt echter ook gesproken over een periode van 11,5 dagen (CI 95% 8,2 – 15,6) die nodig zou zijn om symptomen te ontwikkelen (Kluytmans et al, 2020; Liu et al, 2020). De auteurs van deze publicaties concluderen dat er soms veel tijd zit tussen ‘het hebben van symptomen’ en ‘ziek worden’. Die lange tijd impliceert een periode van dragerschap waarbij de gastheer (nog) weinig tot geen symptomen laat zien. Het is bekend dat er in deze fase wel virusdeeltjes op mucosale weefsels aantoonbaar zijn, maar het is onbekend in hoeverre deze bijdragen aan besmettelijkheid.
Meerdere onderzoeken over dit asymptomatische dragerschap geven aan dat SARS-CoV-2 lijkt op influenza; er is overdracht mogelijk in de asymptomatische periode. In de meeste gevallen zijn er geen verschillen gevonden in de virusload tussen symptomatische en asymptomatische virusdragers (Zou et al, 2020). Daarom is het zeer waarschijnlijk dat asymptomatisch dragerschap bestaat en vooralsnog een bron kan zijn voor besmetting in de mondzorg. Daarbij worden lichte (verkoudheids)klachten ook onderkend als mogelijke symptomen van besmetting met SARS-CoV-2 (Bai et al, 2020; Lai et al, 2020). Hoewel er op dit moment geen prevalentiecijfers beschikbaar zijn voor Nederland moet rekening worden gehouden dat het virus zich alom verspreid heeft onder de bevolking (Kluytmans et al, 2020; RIVM, 2020a). Daarom dient het uitgangspunt te zijn dat elke patiënt die een mondzorgpraktijk bezoekt, mogelijk besmet is met het virus. Dit is in lijn met het advies van de RIVM op dit moment, dat geen speciale aandacht meer geeft aan een recente reisgeschiedenis naar een gebied met veel COVID-19-patiënten of aan recent contact met een COVID-19-patiënt en anderzijds juist vasthoudt aan een richtlijn van 1,5 meter afstand tussen mensen.
De case fatality rate (het aantal overleden patiënten gedeeld door het aantal patiënten gediagnosticeerd met de ziekte) van dit virus, gerapporteerd in China, bedraagt 3-11% (Rajgor et al, 2020). Daarnaast treden vaak slechts milde klachten op. Besmette personen kunnen zo op een normale wijze blijven deelnemen aan het maatschappelijk leven, waardoor het waarschijnlijk is dat mondzorgverleners in aanraking komen met het virus (Chen, 2020). Deze case fatality rate is echter gebaseerd op het aantal doden per daadwerkelijk vastgestelde casus. Het is zeer goed mogelijk dat de komende periode, wanneer er meer getest gaat worden, het getal van de case fatality rate zal dalen.
Transmissie van SARS-CoV-2 in de mondzorg
De transmissie van het virus SARS-CoV-2 vindt voornamelijk plaats via besmetting met druppels (Ong et al, 2020). Deze druppels worden, door bijvoorbeeld spreken, uitgescheiden vanuit de mond en keelholte en komen doorgaans niet verder dan 1,5 meter. Bij hoesten en niezen worden ook kleinere deeltjes uitgescheiden, de zogenoemde aerosolen die verder komen dan 1,5 meter (Jones en Brosseau, 2015). Het advies van de rijksoverheid aan de bevolking op dit moment is om zoveel mogelijk thuis te blijven, 1,5 meter afstand te houden en de handen vaker te wassen (Rijksoverheid, 2020).
Hoewel aerosolen bij de meeste dagelijkse bezigheden geen grote rol spelen, is de situatie in de mondzorgpraktijk anders; daar zorgt de gebruikte waternevel voor aerosolen die gecontamineerd worden met materiaal uit de mond. In de medische praktijk wordt naast overdracht van het virus via druppels ook overdracht via aerosolen gesuggereerd (Wax en Christian, 2020). Omdat er bij een op SARS-CoV-2 positief geteste patiënt veel virusdeeltjes in het speeksel en op de tongrug aanwezig zijn, is het zeer aannemelijk dat de via deze route gecontamineerde aerosolen tevens virusdeeltjes bevatten (RIVM, 2020b; Liu et al, 2020). Verschillende typen coronavirussen blijken al te kunnen worden gedetecteerd in aerosolen die ontstaan bij uitademen (Leung et al, 2020). Het mondzorgteam werkt op (minder dan) 60 centimeter afstand van de mond van een patiënt en de aerosolen in de mondzorgpraktijk worden met water en luchtdruk geproduceerd en verspreiden zich buiten de mond van de patiënt. Uit recent onderzoek van het ACTA uitgevoerd door Zemouri et al, waarvan de resultaten zijn voorgelegd voor wetenschappelijke publicatie, blijkt dat de grootste microbiologische besmetting binnen de mondzorgpraktijk op minder dan 1 meter afstand vanaf de mond plaatsvindt, via zowel spatten als aerosolen.
Ook na afloop van de behandeling blijven aerosolen aanwezig in de behandelruimte, waarbij de zwaardere en grotere deeltjes sneller neerslaan (Bennett et al, 2000). Ventilatie door luchtverversing in de ruimte geeft verdunning van deze aerosolen en daarmee vermindering van de bacteriën en virussen. Van influenzavirussen is bekend dat deze 30 minuten na afloop van aerosolverspreiding nog aantoonbaar waren in de lucht (Nikitin et al, 2014). Het is niet bekend in hoeverre dit kan bijdragen aan een nieuwe infectie. Overdracht van het SARS-CoV-2-virus via oppervlakken vindt mogelijk ook plaats, omdat het virus op bijvoorbeeld kunststof oppervlakken na 72 uur nog aantoonbaar is en soms na 9 dagen nog wordt aangetroffen (Van Doremalen et al, 2020). Er is niet vastgesteld en daardoor onduidelijk of deze virusdeeltjes dan nog een infectie kunnen veroorzaken. Alle gecontamineerde oppervlakken waarop aerosol terecht is gekomen of die de patiënt heeft aangeraakt, zijn potentieel besmet met SARS-CoV-2. Vanwege dit potentiële risico is het begrijpelijk dat het RIVM adviseert om zoveel mogelijk alleen pinbetalingen uit te voeren, winkelwagentjes schoon te maken voor gebruik en regelmatig de handen te wassen. Voorheen ging men in het algemeen ervan uit dat oppervlakken zoals deurkrukken, de balie en de kraan in de toiletruimte in mondzorgpraktijken niet sterker gecontamineerd zijn dan een willekeurig object in de openbare ruimte.
De aanname dat voornamelijk gezonde patiënten de mondzorgpraktijk bezoeken, waarop de KNMT-richtlijn uit 2016 is gebaseerd, kan dus niet meer onverkort van toepassing worden geacht tijdens de uitbraak van COVID-19. Overdracht van het virus kan via direct contact, indirect contact en aerosolen plaatsvinden. Die overdracht vindt plaats van patiënten naar het mondzorgteam en vice versa, tussen patiënten en tussen leden van het mondzorgteam onderling (Peng et al, 2020). Dit geldt ook bij een asymptomatische patiënt, zoals eerder gesteld.
Infectiepreventiemaatregelen
Bij opkomende infectieziekten is er vaak niet direct aandacht voor de consequenties ervan voor het verlenen van mondzorg en ontbreekt het aan adviezen die voldoende toegespitst zijn op de nieuwe situatie en de bijzondere infectiepreventiemaatregelen die in deze specifieke situaties dienen te worden toegepast (Monaghan, 2016). Op basis van de op dit moment beschikbare wetenschappelijke publicaties over COVID-19-infectiepreventiemaatregelen, wordt in dit artikel, vanuit de afdelingen Infectiepreventie van 2 Nederlandse (sub)faculteiten Tandheelkunde, een interpretatie gegeven voor de mondzorg.
Bescherming tegen werkgerelateerde aandoeningen kan worden toegepast op verschillende niveaus. Het National Institute for Occupational Safety and Health (NIOSH) uit de Verenigde Staten doet onderzoek en geeft aanbevelingen om werkgerelateerde aandoeningen te voorkomen. Maatregelen die ingrijpen op een niveau dichter bij de bron van het virus zijn over het algemeen effectiever en bieden meer bescherming dan maatregelen die dichterbij de mondzorgverlener staan (afb. 2).
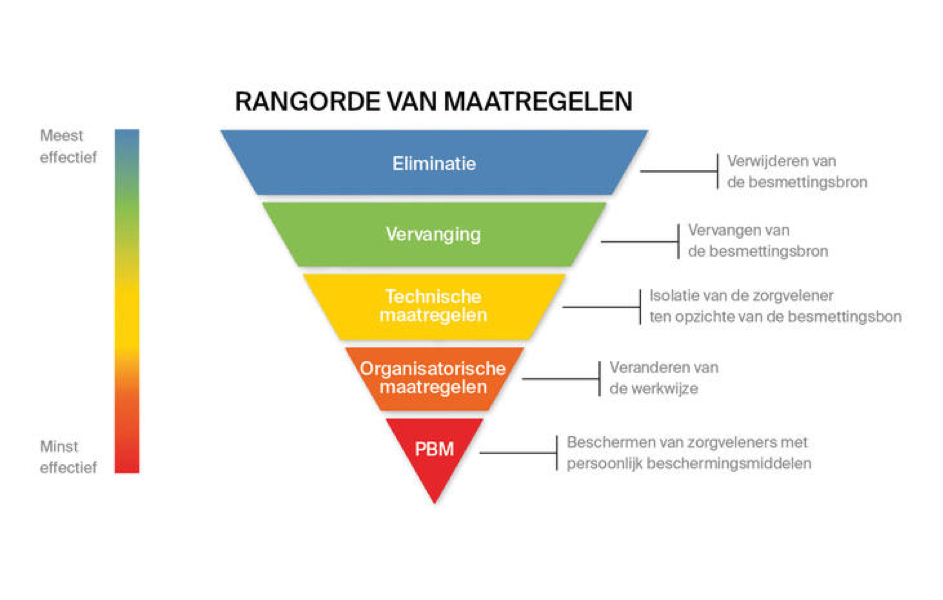
Afb. 2. Beheersing van blootstelling aan beroepsrisico's is de methode om zorgverleners te beschermen. Hiervoor kan deze hiërarchie worden gebruikt om te bepalen hoe haalbare en effectieve oplossingen kunnen worden geïmplementeerd in de praktijk (vertaalde versie van afbeelding van National Institute for Occupational Safety and Health (NIOSH, 2015) van het Center for Disease Control and Prevention (CDC) in de Verenigde Staten).
Eliminatie
Op het eerste niveau kan de bron worden geëlimineerd; in dit geval kan dat door niet in contact te komen met een besmette patiënt. Dat is een basisbeginsel waarop de richtlijn ‘Infectiepreventie in mondzorgpraktijken’ is gebaseerd (KNMT, 2016). De aanname is dat een besmettelijke patiënt dusdanig ziek is dat deze niet naar de praktijk zal komen of naar aanleiding van de anamnese wordt besloten om deze patiënt niet te behandelen dan wel van een bepaald type behandeling voorlopig af te zien. In de huidige situatie is niet duidelijk of een patiënt besmettelijk is. Daardoor kan bescherming op dit niveau alleen gecreëerd worden door het behandelen uit te stellen. Dit is in lijn met het op dit moment geldende advies van de overheid, dat onder andere bestaat uit het zoveel mogelijk contact te vermijden door thuis te blijven. In de meeste landen is op dit moment de mondzorg afgeschaald tot het uitsluitend verlenen van spoedzorg (Meng et al, 2020). Het gaat om de behandeling van patiënten met acute pijn, trauma, nabloedingen en andere aandoeningen waarbij onherstelbare schade is te verwachten en uitstel derhalve niet verantwoord is (WGBO, normen beroepsgroep).
Wanneer toch zorg verleend moet worden, is eliminatie van de infectieuze bron op een andere wijze de aangewezen eerste stap in het voorkomen van transmissie. Hygiëne van de handen en oppervlakken zijn altijd al belangrijke maatregelen tegen verspreiding van virussen, zo ook van SARS-CoV-2 in de maatschappij en in de gezondheidszorg (Nicolaides et al, 2019; Lotfinejad et al, 2020; Lynch et al, 2020; Ran et al, 2020). Dit is ook van toepassing op de mondzorg. Door reinigen wordt het virus mechanisch verwijderd, terwijl met desinfectie het virus wordt geïnactiveerd. Desinfectie van met SARS-CoV-2 gecontamineerde oppervlakken kan effectief binnen een inwerktijd van 1 minuut plaatsvinden, door het toepassen van a) minimaal 62% alcohol, of b) 0,5% waterstofperoxide, of c) 0,1% (oftewel 1.000 ppm) natriumhypochloriet (Kampf et al, 2020).
De procedures voor reiniging, desinfectie en sterilisatie van instrumenten kunnen onverminderd worden uitgevoerd worden zoals beschreven in de richtlijn ‘Infectiepreventie in mondzorgpraktijken’: het virus wordt reeds verwijderd bij zorgvuldige reiniging. Wel is hierbij machinale reiniging sterk aanbevolen (thermodesinfector) om transmissie door bijvoorbeeld spatten tijdens het reinigen te voorkomen. Reiniging en desinfectie van oppervlakken in de praktijk kunnen onverkort plaatsvinden zoals beschreven in de richtlijn en hierboven (Kampf et al, 2020).
Technische maatregelen
Het risico kan verder worden verlaagd door de hoeveelheid aerosol tijdens de behandeling te verminderen, allereerst door het nemen van technische maatregelen. Het is aan te bevelen om, indien mogelijk, te werken met onderdruk (afzuiging van lucht zodat deze niet vanuit de ruimte naar de omgeving stroomt) of anders met goede ventilatie door luchtverversing in de ruimte (Meng et al, 2020), omdat hierdoor verdunning van de virusload plaatsvindt (Stockwell et al, 2019). Dit kan door de gebruikelijke mechanische ventilatie, maar het is beter dit te optimaliseren door de luchtverversing sterk te verhogen of de lucht te filteren dan wel te desinfecteren. De natuurlijke ventilatie kan worden verbeterd door te zorgen voor een open communicatie met de buitenlucht (Escombe et al, 2019). In de praktijk kan dit door het actief ventileren en indien mogelijk goed doortochten van de ruimte. Daarbij dient men erop bedacht te zijn dat de lucht vanuit de behandelkamer gecontamineerd is. Daarom is het van belang dat personen in de omgeving, zowel binnen in bijvoorbeeld de wachtkamer als buiten bij het raam of ventilatiekanaal van de praktijk, niet hiermee in aanraking komen. Door verspreiding van virusdeeltjes via een luchtstroom heeft, mogelijk in een enkel geval, verspreiding van het MERS-virus kunnen plaatsvinden (Sung et al, 2018).
Organisatorische maatregelen
Verdere reductie van het risico kan plaatsvinden door de reguliere werkwijze in mondzorgpraktijken aan te passen. Een belangrijke transmissieroute is door direct en indirect contact met besmette personen en voorwerpen. Daarom is het belangrijk om bewustzijn te creëren bij het team en onnodige contacten te vermijden.
Bij behandeling kan de virusload waarmee men in contact komt worden verlaagd door het zoveel mogelijk toepassen van een lekvrije rubberdam (Cochran et al, 1989; Samaranayake et al, 1989). Hiervoor dient na het aanbrengen van de rubberdam het werkveld gedesinfecteerd te worden. Dit kan praktisch bijvoorbeeld door het drenken van een gaasje in een desinfectans waarmee de rubberdam en de gebitselementen worden gedesinfecteerd. Verder kan rubberdam bijdragen aan het verminderen van de hoeveelheid spatten (Dahlke et al, 2012). Handelingen waarbij kokhalsreflexen of hoesten worden uitgelokt moeten worden vermeden.
Op dit niveau van bescherming kan de behandeling ook dusdanig worden aangepast dat zo min mogelijk aerosol verspreid wordt: bijvoorbeeld door het gebruik van handinstrumenten in plaats van watergekoeld instrumentarium of ultrasone reiniging (Harrel et al, 1998). Zie daarom zoveel mogelijk af van het gebruik van een airrotor. Wel kan excavatie met de hand of gebruik van een (rood) hoekstuk met alleen water (dus zonder lucht) plaatsvinden, en een speekselafzuiger in plaats van de meerfunctiespuit worden toegepast. Bovendien is adequate speeksel- en nevelafzuiging van groot belang (Devker et al, 2012; Narayana et al, 2016).
Na afloop van de behandeling blijft aerosol nog in de lucht aanwezig. Virusdeeltjes en bacteriën kunnen 30 minuten na aerosolvorming nog in de lucht worden gedetecteerd (Bennett et al, 2000; Nikitin et al, 2014). Transmissie naar onbeschermde mondzorgverleners tussen 2 behandelingen door of naar een volgende patiënt moet worden voorkomen. Daarom moet na een behandeling waarbij mogelijk aerosolen zijn gevormd, ten minste 30 minuten worden gewacht tot de deeltjes zijn neergedaald. Als alternatief kan enige tijd goede ventilatie worden toegepast. Deze tijd is afhankelijk van de mate van luchtverversing die mogelijk is. Onderzoeksgegevens over de exacte duur van ventileren bij een patiënt besmet met SARS-CoV-2 zijn op dit moment nog niet beschikbaar.
In een recente publicatie wordt gesuggereerd dat het spoelen van de mond met waterstofperoxide (1% H2O2) zinvol kan zijn in het verlagen van het risico op overdracht (Peng et al, 2020). In de publicatie ontbreekt het echter aan een duidelijke onderbouwing. De meeste virusdeeltjes zijn aanwezig in de keel, op de tong en in het speeksel en zullen snel na het spoelen weer aanwezig zijn in de mond (Liu et al, 2011; Xu et al, 2020; Zou et al, 2020). Een systematisch literatuuronderzoek laat zien dat het spoelen met allerlei andere oraal toegepaste desinfectantia de microbiologische load in aerosolen vermindert (Marui et al, 2019), maar het is hierbij onduidelijk of deze vermindering klinisch relevant is en wat het effect is tijdens het verdere verloop van de (voorgenomen) behandeling.
Persoonlijke beschermingsmiddelen
Algemeen kan gesteld worden dat wanneer afscherming vanaf de bron onvoldoende bescherming biedt, het toepassen van directe bescherming van de mondzorgverlener, door het dragen van persoonlijke beschermingsmiddelen, aan de orde is. Omdat elke patiënt dient te worden beschouwd als drager van het SARS-CoV-2-virus is het gebruik van aanvullende persoonlijke beschermingsmiddelen geïndiceerd. Aangezien de luchtwegen de voornaamste porte d’entrée van het virus zijn, is het belangrijkste de luchtwegen af te schermen. De slijmvliezen van de ogen worden voldoende afgeschermd door een spatbril. Een intacte huid biedt een goede barrière tegen het SARS-CoV-2-virus. De productie van aerosolen in de mondzorg resulteert erin dat richtlijnen zoals de Landelijke Coördinatie Infectiebestrijding (LCI)-richtlijn ‘COVID-19’ of de NVMM-Leidraad niet één op één over te nemen zijn in de mondzorg (RIVM, 2020b; NVMM, 2020). De ziekenhuisrichtlijnen gaan in dergelijke gevallen uit van maximale bescherming bij aerosolvormende procedures met behulp van FFP-2 maskers (FFP: Filtering Facepiece Particle) (Werkgroep Infectie Preventie, 2011a; Werkgroep Infectie Preventie, 2011b).
FFP-2 maskers filteren deeltjes aanzienlijk beter en vertonen minder randlekkage vergeleken met de reguliere chirurgische mondneusmaskers (type IIR, niet vochtdoorlatend). De NEN-EN- norm voor FFP-2 maskers staat maximaal 8% lekkage via het filter en langs de rand toe (Werkgroep Infectie Preventie, 2017). In onderzoek naar bescherming tegen fijne deeltjes gaven FFP-2 maskers 9% totale lekkage, terwijl dat voor chirurgische mondneusmaskers 35% was (Steinle et al, 2018). In een systematisch literatuuronderzoek naar klinisch onderzoek over mondneusmaskers is het effect van verbeterde filtratie door FFP-2 maskers in vergelijking tot chirurgische mondneusmaskers niet terug te zien in een vermindering van luchtweginfecties bij zorgverleners (Long et al, 2020). Aangetekend dient te worden dat deze onderzoeken werden uitgevoerd in de algemene gezondheidszorg, waar slechts in beperkte mate aerosolvormende handelingen plaatsvonden. De effectiviteit van FFP-2 maskers is daarbij sterk afhankelijk van het correct toepassen van de instructies bij het gebruik (zie intermezzo 3). Door gebruik van FFP-2 maskers worden de risico’s aanzienlijk verlaagd, maar niet volledig weggenomen.
Intermezzo 3. Voorbeeld van het gebruik van een FFP-2 masker
- Zorg voor een gladgeschoren gezicht, verwijder oorbellen en andere materialen die mogelijk een goede pasvorm van het masker beïnvloeden.
- Plaats het masker zodanig dat de mond en de neus volledig worden afgeschermd. Besteed nauwkeurig aandacht aan de aansluiting op de neusbrug.
- Bij 2 elastieken op het achterhoofd: de elastieken mogen niet gekruist worden, plaats het onderste elastiek in de nek en het bovenste elastiek op het achterhoofd.
- Controleer op mogelijke lekkage door de handen langs de randen te houden en stevig uit te blazen. Verplaats het masker bij lekkage van lucht en herhaal daarna de test.
- Vermijd contact met het masker tijdens het dragen.
- Vervang het masker als het nat of vuil is geworden, doe dit zonder de voorzijde van het masker aan te raken.
- Gooi het masker direct na gebruik weg.
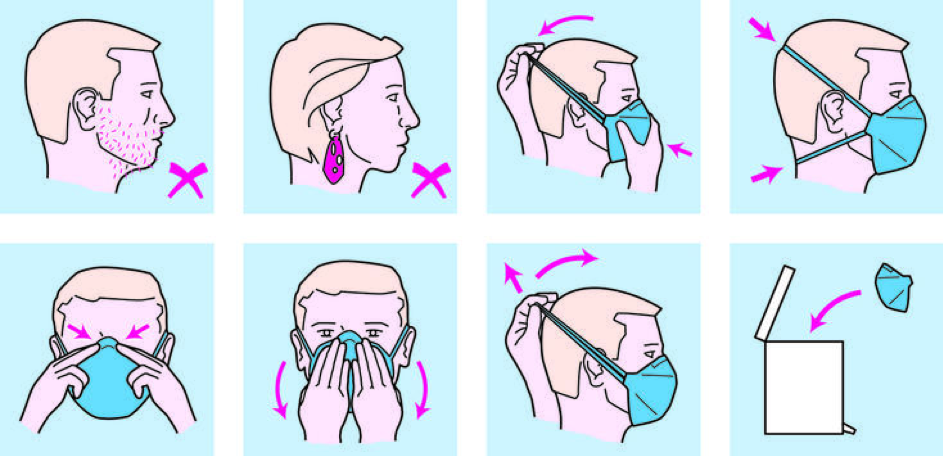
(Illustrator: Frans Hessels)
NB. Een FFP-2 masker op zichzelf is in de mondzorgpraktijk niet voldoende tegen transmissie met SARS-CoV-2, maar dient altijd vergezeld te worden van andere maatregelen, zoals in de tekst genoemd.
Het is essentieel dat beschermingsmiddelen voldoen aan de Europese normen om adequate bescherming te kunnen bieden. Het FFP-2 masker moet voldoen aan de norm NEN-EN 149 + A1, zodat het voldoende filtert en daarmee de behandelaar beschermt. Vanwege de kans op spatten en spuiten in het gezicht is het bij het gebruik van een FFP-2 masker ook belangrijk ervoor te zorgen dat deze tevens voldoet aan de eisen van niet-vochtdoorlatendheid van een chirurgisch mondneusmasker type IIR (Werkgroep Infectie Preventie, 2017). De Inspectie Gezondheidszorg en Jeugd staat nu ook middelen toe die van buiten de Europese Unie komen. Ze moeten dan wel in een deugdelijke staat verkeren en voldoen aan gelijkwaardige normen. Zo zijn maskers van het type KN95 en KP95 uit China en het type N95, P95 en R95 uit de Verenigde Staten ook toegestaan.
Hoewel het meeste onderzoek naar het verschil tussen de maskers niet kwalitatief hoog genoeg is om definitief uitsluitsel te geven, is vooralsnog de standaard en het advies om bij aerosolvormende handelingen bij met SARS-CoV-2 besmette patiënten een FFP-2 masker te dragen (RIVM, 2020b; WHO, 2020).
De slijmvliezen van de ogen zijn een andere mogelijke porte d’entrée. Om deze te beschermen dient gewerkt te worden met een spatbril of gelaatsscherm (Werkgroep Infectie Preventie, 2011a; Werkgroep Infectie Preventie, 2011b). Een gelaatsscherm heeft als voordeel dat er minder spatten terechtkomen op een mondneusmasker waardoor het masker minder snel verzadigd raakt met vocht. Ook is overdracht via de standaard beschermende kleding mogelijk. Dit kan voorkomen worden door te werken met een spatwaterdicht schort met lange mouwen, gedragen over de standaard beschermende kleding heen en deze, na iedere behandeling waarbij aerosolen zijn vrijgekomen, te vervangen (Werkgroep Infectie Preventie, 2011a; Werkgroep Infectie Preventie, 2011b). Om verspreiding via contact met andere lichaamsdelen te voorkomen is het gebruik van gesloten, afneembare schoenen en spatwaterdichte hoofdbedekking nodig. Daar waar persoonlijke beschermingsmiddelen de huid onbeschermd laten, dient zorgvuldige reiniging en/of desinfectie plaats te vinden. In een zeer recente publicatie uit China wordt vermeld dat het toepassen van alle hierboven opgesomde infectiepreventiemaatregelen effectief bleken bij het voorkomen van nieuwe infecties met SARS-CoV-2 in de mondzorgpraktijk (Meng et al, 2020).
Toekomstperspectief bijzondere maatregelen mondzorg
De huidige pandemie vraagt in deze fase om aanvullende infectiepreventiemaatregelen in de zorg, het uitstellen van electieve zorg en het alleen bij spoed verlenen van mondzorg om verspreiding van het virus te voorkomen. Het risico voor het team en de patiënt is op dit moment groter dan gebruikelijk. Dit komt niet enkel omdat de kans op besmetting mogelijk groter is, maar vooral omdat de negatieve gezondheidseffecten van COVID-19 aanzienlijk zijn. Het ziektebeeld verloopt zeer ongunstig bij een deel van de geïnfecteerde personen. De beschreven aangepaste werkwijze streeft in deze situatie naar een maximaal effect in plaats van een optimaal effect. De bijzondere maatregelen kunnen opnieuw worden overwogen en mogelijk op termijn gradueel worden afgeschaald, zodra het RIVM aangeeft dat de infectiegraad binnen de populatie weer acceptabel is gedaald en de beschikbare capaciteit van de algemene gezondheidszorg en in het bijzonder de intensive care units weer op een normaal niveau is.
Op dit moment is nog geen indicatie te geven op welke wijze dit gradueel afschalen kan plaatsvinden. Hierbij is het bijvoorbeeld van belang hoeveel mensen daadwerkelijk zijn besmet, of er immuniteit kan optreden na een doorgemaakte infectie, of er een effectieve behandeling wordt gevonden tegen een ernstig verlopende infectie en of het concept van groepsimmuniteit van toepassing zal zijn. Bij het gradueel afschalen moet een afweging gemaakt worden tussen de risico’s en de haalbaarheid. Er kan bijvoorbeeld een selectie gemaakt worden van patiënten die veilig behandeld kunnen worden. Bij patiënten zonder klachten of verhoging dan wel koorts en geen verdenkingen na een medische anamnese (na goed doorvragen op COVID-19 specifieke vragen), is het risico op besmetting met SARS-CoV-2 relatief het laagst. Een COVID-19-sneltest zou in de mondzorg overwogen kunnen worden, mochten in de toekomst voldoende, betrouwbare en betaalbare testen beschikbaar komen.
De komende periode verwachten we meer informatie uit gebieden waar de infectiegraad in de populatie zodanig gedaald is dat het normale leven weer wordt opgepakt. Naar aanleiding van die gegevens moeten de risico’s voor zowel patiënten als mondzorgverleners bij het afschalen van de bijzondere maatregelen ná de coronapandemie zorgvuldig worden afgewogen. We verwachten de komende periode een graduele afname van de hoeveelheid COVID-19-patiënten in de Nederlandse populatie. Na zorgvuldige afweging van de infectierisico’s kunnen gradueel de bijzondere maatregelen worden afgeschaald.
Concluderende opmerkingen
- COVID-19 is een opkomende infectieziekte met wijdverspreide transmissie van het coronavirus SARS-CoV-2 in Nederland. Een deel van de geïnfecteerde personen wordt ernstig ziek. Een deel van de besmette personen vertoont geen symptomen, maar kan wel bijdragen aan transmissie van het virus.
- SARS-CoV-2 wordt uitgescheiden via de mond en kan verspreid worden via aerosolen. Daarom is er een verhoogde kans op het risico van verspreiding hiervan tijdens aerosolproducerende behandelingen in mondzorgpraktijken.
- In verband met risico op besmetting van het mondzorgteam en de patiënten is het, op basis van de huidige beschikbare literatuur, in deze fase van de pandemie zeer sterk te adviseren bij spoedeisende mondzorg aanvullende infectiepreventiemaatregelen te nemen bij alle patiënten. Overige behandelingen dienen te worden uitgesteld.
- Op geleide van de wetenschappelijke literatuur en adviezen vanuit het RIVM dient te worden afgewogen welke infectiepreventiemaatregelen nodig zijn bij het verlenen van spoedeisende en reguliere mondzorg voor de huidige situatie en in de toekomst.
Literatuur
- Adhikari SP, Meng S, Wu YJ, et al. Epidemiology, causes, clinical manifestation and diagnosis, prevention and control of coronavirus disease (COVID-19) during the early outbreak period: a scoping review. Infect Dis Poverty 2020; 9: 29.
- Ashour HM, Elkhatib WF, Rahman MM, Elshabrawy HA. Insights into the recent 2019 novel coronavirus (SARS-CoV-2) in light of past human coronavirus outbreaks. Pathogens 2020; 9: 186.
- Bai Y, Yao L, Wei T, et al. Presumed asymptomatic carrier transmission of COVID-19. JAMA 2020; Epub 21 februari.
- Bennett AM, Fulford MR, Walker JT, Bradshaw DJ, Martin MV, Marsh PD. Microbial aerosols in general dental practice. Br Dent J 2020; 189: 664-667.
- Centers for Disease Control and Prevention. Guidelines for infection control in dental health-care settings. MMWR (52 (RR-17). 2003.
- Chen J. Pathogenicity and transmissibility of 2019-nCoV-A quick overview and comparison with other emerging viruses. Microbes Infect 2020; 22: 69-71.
- Cochran MA, Miller CH, Sheldrake MA. The efficacy of the rubber dam as a barrier to the spread of microorganisms during dental treatment. J Am Dent Assoc 1989; 119: 141-144.
- Dahlke WO, Cottam MR, Herring MC, Leavitt JM, Ditmyer MM, Walker RS. Evaluation of the spatter-reduction effectiveness of two dry-field isolation techniques. J Am Dent Assoc 2012; 143: 1199-1204.
- Devker N, Mohitey J, Vibhute A, et al. A study to evaluate and compare the efficacy of preprocedural mouthrinsing and high volume evacuator attachment alone and in combination in reducing the amount of viable aerosols produced during ultrasonic scaling procedure. J Contemp Dent Pract 2012; 13: 681-689.
- van Doremalen N, Bushmaker T, Morris DH, et al. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1. N Engl J Med 2020; Epub 18 maart.
- Escombe AR, Ticona E, Chávez-Pérez V, Espinoza M, Moore DAJ. Improving natural ventilation in hospital waiting and consulting rooms to reduce nosocomial tuberculosis transmission risk in a low resource setting. BMC Infect Dis 2019; 19: 88.
- Harrel SK, Barnes JB, Rivera-Hidalgo F. Aerosol and splatter contamination from operative site during ultrasonis scaling. J Am Dent Assoc 1998; 129: 1241-1249.
- Heesterbeek H. Het modelleren van besmettelijke ziekten in gestructureerde populaties. Infectieziekten-Bulletin 1993; 4 (2): 21-28.
- Jones RM, Brosseau LM. Aerosol transmission of infectious disease. J Occup Environ Med 2015; 57: 501-508.
- Kampf G, Todt D, Pfaender S, Steinmann E. Persistence of coronaviruses on inanimate surfaces and their inactivation with biocidal agents. J Hosp Infect 2020; 104: 246-251.
- Khan S, Siddique R, Shereen MA, et al. The emergence of a novel coronavirus (SARS-CoV-2), their biology and therapeutic options. J Clin Microbiol 2020; JCM.00187-00120. Epub 11 maart 2020.
- Kluytmans M, Buiting A, Bentvelsen R, et al. SARS-CoV-2 infection in 86 healthcare workers in two Dutch hospitals in March 2020. MedRxiv 2020.03.23.20041913.
- KNMT. Richtlijn Infectiepreventie voor mondzorgpraktijken. Utrecht: KNMT, 2016.
- Lai CC, Yen Hung Liu YH, Wang CY, et al. Asymptomatic carrier state, acute respiratory disease, and pneumonia due to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2): Facts and myths. J Microbiol Immunol Infect 2020; Epub 4 maart.
- Lauer SA, Grantz KH, Bi Q, et al. The incubation period of Coronavirus Disease 2019 (COVID-19) from publicly reported confirmed cases: estimation and application. Ann Intern Med 2020; Epub 10 maart.
- Leung NHL, Chu DKW, Shiu EYC, et al. Respiratory virus shedding in exhaled breath and efficacy of face masks. Nat Med 2020; Epub 3 april.
- Liu L, Wei Q, Alvarez X, et al. Epithelial cells lining salivary gland ducts are early target cells of severe acute respiratory syndrome coronavirus infection in the upper respiratory tracts of rhesus macaques. J Virol 2011; 85: 4025-4030.
- Liu Y, Gayle AA, Wilder-Smith A, Rocklöv J. The reproductive number of COVID-19 is higher compared to SARS coronavirus. J Travel Med 2020; 27: taaa021.
- Long Y, Hu T, Liu L, et al. Effectiveness of N95 respirators versus surgical masks against influenza: a systematic review and meta-analysis. J Evid-Based Med 2020; 1? 9.
- Lotfinejad N, Peters A, Pittet D. Hand hygiene and the novel coronavirus pandemic: The role of healthcare workers. J Hosp Infect 2020; Epub 19 maart.
- Lynch C, Mahida N, Oppenheim B, Gray J. Washing our hands of the problem. J Hosp Infect 2020; Epub 10 maart.
- Marui VC, Souto MLS, Rovai, ES, Romito GA, Chambrone L, Pannuti CM. Efficacy of preprocedural mouthrinses in the reduction of microorganisms in aerosol: A systematic review. J Am Dent Assoc 2019; 150: 1015-1026.e1011.
- Meng L, Hua F, Bian Z. Coronavirus Disease 2019 (COVID-19): emerging and future challenges for dental and oral medicine. J Dent Res 2020; Epub 12 maart.
- Monaghan NP. Emerging infections – implications for dental care. Br Dent J 2016; 221: 13-15.
- Munster VJ, Koopmans M, van Doremalen N, van Riel D, de Wit E. A novel coronavirus emerging in China—key questions for impact assessment. N Engl J Med 2020; 382: 692-694.
- Narayana TV, Mohanty L, Sreenath G, Vidhyadhari P. Role of preprocedural rinse and high volume evacuator in reducing bacterial contamination in bioaerosols. J Oral Maxillofac Pathol 2016; 20: 59-65.
- National Institute for Occupational Safety and Health (NIOSH). Hierarchy of controls. Overview. NIOSH, 13 januari 2015.
- Nicolaides C, Avraam D, Cueto-Felgueroso L, González MC, Juanes,R. Hand-hygiene mitigation strategies against global disease spreading through the air transportation network. Risk Anal 2019; Epub 23 december.
- Nikitin N, Petrova E, Trifonova E, Karpova O. Influenza virus aerosols in the air and their infectiousness. Adv Virol 2014; 859090.
- NVMM (werkgroep HIP). Leidraad versie 1-110320. Infectiepreventiemaatregelen om de verspreiding van COVID-19 te voorkomen of te verkleinen in gezondheidsinstellingen. Leeuwarden: NVMM, 11 maart 2020.
- Ong SWX, Tan YK, Chia PY, et al. Air, Surface environmental, and personal protective equipment contamination by severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) from a symptomatic patient. JAMA 2020; Epub 4 maart.
- Peng X, Xu X, Li Y, Cheng L, Zhou X, Ren B. Transmission routes of 2019-nCoV and controls in dental practice. Int J Oral Sci 2020; 12: 9.
- Rajgor DD, Lee MH, Archuleta S, Bagdasarian N, Quek SC. The many estimates of the COVID-19 case fatality rate. Lancet Infect Dis 2020; Epub 27 maart.
- Ran L, Chen X, Wang Y, Wu W, Zhang L, Tan X. Risk factors of healthcare workers with corona virus disease 2019: a retrospective cohort study in a designated hospital of Wuhan in China. Clin Infect Dis 2020; Epub 17 maart.
- Rijksoverheid. Coronavirus COVID-19. https://www.rijksoverheid.nl/onderwerpen/coronavirus-covid-19. Geraadpleegd 4 april 2020.
- RIVM. Rapport Epidemiologische situatie COVID-19 in Nederland 4 april 2020. Bilthoven. RIVM, 2020a.
- RIVM. LCI-richtlijn COVID-19. Bilthoven: RIVM, 2020b. https://lci.rivm.nl/richtlijnen/covid-19. Geraadpleegd 4 april 2020..
- Samaranayake LP, Reid J, Evans D. The efficacy of rubber dam isolation in reducing atmospheric bacterial contamination. ASDC J Dent Child 1989; 56: 442-444.
- Steinle S, Sleeuwenhoek A, Mueller W, et al. The effectiveness of respiratory protection worn by communities to protect from volcanic ash inhalation. Part II: Total inward leakage tests. Int J Hyg Environ Health 2018; 221: 977-984.
- Stockwell RE, Ballard EL, O'Rourke P, Knibbs LD, Morawska L, Bell SC. Indoor hospital air and the impact of ventilation on bioaerosols: a systematic review. J Hosp Infect 2019; 103: 175-184.
- Sun J, He WT, Wang L, Lai A, et al. COVID-19: epidemiology, evolution, and cross-disciplinary perspectives. Trends Mol Med 2020; Epub 21 maart.
- Sung M, Jo S, Lee SE, Ki M, Choi BY, Hong J. Airflow as a possible transmission route of Middle East Respiratory Syndrome at an initial outbreak hospital in Korea. Int J Environ Res Public Health 2018; 15: 2757.
- Vaduganathan M, Vardeny O, Michel T, McMurray JV, Pfeffer MA, Solomon SD. Renin‚ angiotensin-aldosterone-system inhibitors in patients with Covid-19. N Engl J Med 2020; Epub 30 maart 2020.
- Wax RS, Christian MD. Practical recommendations for critical care and anesthesiology teams caring for novel coronavirus (2019-nCoV) patients. Can J Anesth 2020; Epub 12 februari.
- WHO. Rational use of personal protective equipment (PPE) for coronavirus disease (COVID-19). Interim Guidance. Geneve: WHO, 19 maart 2020.
- Werkgroep Infectie Preventie (WIP). Aërogene isolatie. Leiden: WIP, 2011a.
- Werkgroep Infectie Preventie (WIP). Druppelisolatie. Leiden: WIP, 2011b.
- Werkgroep Infectie Preventie (WIP). Aërogene isolatie. Leiden: WIP, 2013.
- Werkgroep Infectie Preventie (WIP). Persoonlijke beschermingsmiddelen. Leiden: WIP, 2017.
- Xu H, Zhong L, Deng J, et al. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa. Int J Oral Sci 2020; 12: 8.
- Zemouri C, de Soet H, Crielaard W, Laheij A. A scoping review on bio-aerosols in healthcare and the dental environment. PloS One 2017; 12: e0178007.
- Zou J, Ruan F, Huang M, et al. SARS-CoV-2 viral load in upper respiratory specimens of infected patients. N Engl J Med 2020; 382, 970-971.
Dankwoord
De auteurs zijn zeer erkentelijk aan de vele collega’s van de (sub)faculteiten Tandheelkunde die ons van advies hebben voorzien tijdens het schrijven van dit artikel.
